|
血红素分子是需氧生物体内普遍存在的多种蛋白质的辅基,如肌球蛋白、血红蛋白、细胞色素c、过氧化氢酶、过氧化物酶等。在一些病理条件下,生物体内发生严重溶血现象,从而导致自由血红素浓度急剧增加。由于血红素分子中Fe原子的氧化-还原能力,自由血红素可引起体内活性氧基团(ROS)的生成,并导致脂、DNA、蛋白质等多种生物分子及多种组织、器官的氧化损伤。
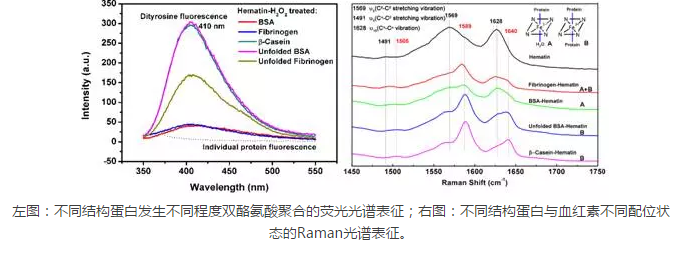
蛋白质双酪氨酸聚合是血红素分子引起的一种重要的氧化损伤形式。已有的研究报道显示,在过氧化氢存在下,血红素可引起多种疾病相关的重要蛋白以双酪氨酸形式聚合。但是,不同蛋白聚合程度存在差别的原因及蛋白质自身性质(如蛋白质结构)对其聚合程度的影响尚不清楚。基于此,中科院技术生物所黄青课题组对此开展了相应研究。研究人员选择牛血清白蛋白(球形蛋白)、纤维蛋白原(线性蛋白)及酪蛋白(天然无序蛋白)等作为研究对象发现,蛋白质结构对血红素引起的双酪氨酸聚合有重要影响。其中,天然无序蛋白及去折叠蛋白易发生双酪氨酸聚合,线性蛋白次之,球形蛋白难以发生聚合。研究人员基于Raman光谱、电子自旋共振光谱等分析发现,蛋白质结构不仅影响了其与血红素分子的配位状态(五配位、六配位),进而影响tyrosyl自由基(双酪氨酸前体)的生成,还影响生成的tyrosyl自由基反应生成双酪氨酸,最终影响蛋白质双酪氨酸的聚合程度。该工作研究成果已经发表于Biochimica et Biophysica Acta (BBA)-General Subjects (doi:10.1016/j.bbagen.2016.04.023)。
上述工作受到中科院“百人计划”、国家自然科学基金、中科院青年创新促进会等项目的资助,还得到中科院强磁场中心在电子自旋共振光谱(ESR)测量上的帮助。
|